一个百亿创新药战场
随着人类在EGFR靶点的不断迭代,尚无产品完全获批的KRAS靶点已然成为肺癌*的“无人区”。
据相关统计数据,非小细胞肺癌是最主流的肺癌种类,占肺癌总患者数的85%。而NSCLC的突变靶点中,EGFR靶点、KRAS靶点、ALK靶点为占比最高的三大靶点,概率分别为35%、33%和5%。
其实早在60多年前,人类就已经明确了KRAS靶点在癌症中的机制,但由于一直没有在KRAS蛋白表面找到典型的抑制位点,因此它曾一度被称为“不可成药”靶点。后来,专家们将KRAS靶点进一步细分,发现KRAS突变主要发生在12号或13号氨基酸残基,可分为G12C、G12D、G13D等多种类型。
在所有的KRAS靶点突变中,G12C突变类型占比最高,约占总KRAS靶点的46%。换句话说,KRAS G12C靶点约占NSCLC患者总数的14%,是现阶段肺癌*的“无人区”。
2013年的时候,Ostrem 等人发现了KRAS G12C 选择性抑制剂,它可以与 KRAS G12C 突变体的半胱氨酸结合,将其锁定在失活构象,从而发挥抑制作用。由此开始,人类才正式找到穿越肺癌*的“无人区”的方法。
01赢家尚未出现
KRAS G12C早已成为各路豪强布局的焦点,但时至今日却依然难有产品能被称为赢家。
过去十年间,共有两款产品通过加速审批的方式,得以上市,分别是安进研发的sotorasib及Mirati Therapeutics研发的adagrasib,它们的国内权益分别被授权给了百济神州和再鼎医药。然而遗憾的是,这两款产品尚没有顺利通过FDA的“转正”批准,依然只能以加速审批的形式获批。
众所周知,一款药物想要在美国实现商业化,必须通过FDA的批准。由于整个审批周期较长,FDA为了鼓励药企对于创新型产品的研发,因此特设了一条先上市后验证的特殊通道——加速审批。加速审批可以用更加简单的代替终点作为审批依据,不过在获批之后必须进行大规模的后续试验来验证被替代的传统临床终点。
一般而言,入选加速审批的药物,必须是针对缺少有效的治疗方法的重大疾病。大多数加速审批药物只有在后续临床验证通过后,才能正式由加速审批转为完全审批。如果后续试验数据欠佳,那么FDA有权撤销这款药物的上市申请。
今年10月初,安进的sotorasib刚刚向FDA申请转正,虽然主要终点无进展生存时间为5.6个月,明显强于对照组的4.5个月,达到了主要终点。但次要终点总生存时间(OS)却并没有显著差异,因此并未获得FDA的通过。
整体来看,虽然已经有两款药物以加速审批的形式获批上市,但却并无*的赢家出现,这给了后来者更多的发展机会。纵观全球布局,两款获批药物之后,已有近10条KRASG12C管线进入临床2期,这其中不乏加科思、益方生物、信达生物等国内玩家。
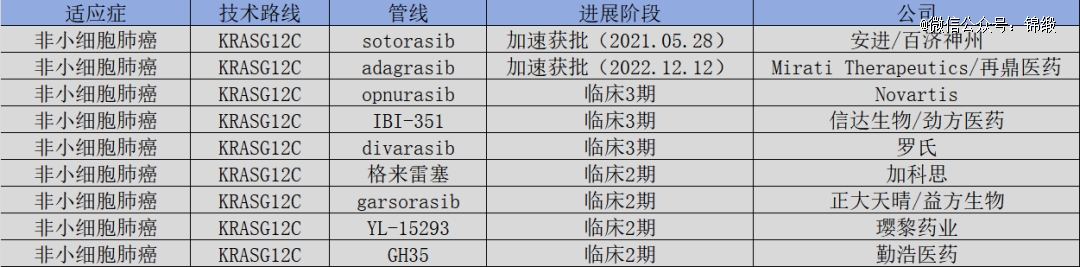
迟迟未有产品顺利“转正”,严重影响了市场对于KRAS G12C药物的信心。目前,已经获批的两款产品的客观缓解率均低于50%,分别为37%和43%,这样的数据显然是无法实现制霸整个靶点的,在新制剂和联合治疗方面都有极大的挖掘空间。
关于这一点,加科思用*的疗效数据向市场证明了KRAS G12C靶点仍有极高的可塑性。10月24日,加科思在欧洲肿瘤内科医学年会上披露了最新数据。格来雷塞以联合用药的方式,实现了NSCLC患者65.5%的ORR和100%的疾病空置率,这项数据都是目前市场*。
格来雷塞仅仅是中国KRAS G12C后起之秀的一个缩影,尽管它公布的数据极为优秀,但能否获得FDA的批准依然是一件不确定的事情,显然KRAS G12C靶点的竞争远比市场想象中的更加激烈。
lt;_o3a_p gt;
02耐药性是*的变数
实际上,即使现在有药品能够正式获得FDA的批准,但它也大概率仅是一个阶段性的*,后续更多迭代产品的出现或是一种必然。
EGFR是目前开发最成熟的肺癌靶点,已经迭代至第三代产品,而其之所以不断出现迭代,核心原因在于始终无法解决的耐药性。与EGFR靶点类似,KRAS靶点也很可能将面临接踵而来的耐药性问题。
参考之前我们研究过的EGFR靶点和ALK靶点,KRAS靶点的耐药性很可能是由三大主要因素造成的。
其一,KRAS G12C虽然是KRAS*的细分突变,但其却仅占总数的46%,除此之外仍有大量其他类型的突变类型存在。在用药的过程中,KRAS的其他细分靶点极有可能也发生突变,从而产生耐药性问题。
其二,KRAS基因G12C的拷贝数扩增也有可能引发药物失效,从而产生耐药性。
其三,NSCLC作为诱发因素极多的癌症种类,极有可能出现获得性旁路耐药机制,如激活了NRAS、BRAF、ALK、RET等其他基因,从而出现了新的耐药性。
除以上三大主要因素外,抑癌基因的缺失、亚型转化等都有可能造成耐药性,人类对于KRAS靶点的挖掘目前仅能算得上是一个开始。
大量的患者基数促使KRAS靶点成为人类抗击肺癌的主要赛道之一,这条赛道不仅很长,而且不确定性极高,算得上是高风险高回报。
lt;_o3a_p gt;
03谁将是KRAS靶点的吉非替尼?
如果KRAS靶点大概率将出现后续迭代产品,那么是否意味着如今的玩家都将成为炮灰呢?其实并非如此。
*款获批的EGFR药物为阿斯利康的吉非替尼,它于2003年获批上市,是EGFR靶点的开创者。尽管由于耐药性和竞品出现,吉非替尼的单年营收峰值仅为6.47亿美元,并未如愿成为“药王级”产品,但其依然为阿斯利康在EGFR靶点的竞争打下了坚实的基础。
绝大多数投资者都严重低估了吉非替尼的价值。即使峰值营收不高,但其依然在整个生命周期中为阿斯利康创造了78.45亿美元的收入,*算得上是一款盈利颇丰的产品。贝达药业就是因为做到了吉非替尼的国产替代,而一度成为中国创新药一哥。
更为重要的是,正是因为吉非替尼的先发优势,让阿斯利康快速捕捉到了EGFR靶点中存在的问题,这也使得在后续产品迭代中,阿斯利康得以抢占先机。如今单年营收突破50亿美元大关的“药王级”产品奥希替尼,就是在吉非替尼基础上研发成功的。
从阿斯利康身上,投资者不难发现,在这场激烈的EGFR靶点竞争中,胜利的天平其实从一开始就已经倾斜。充足的先发优势足以让一家公司在多个世代领跑,这一逻辑同样可以复制到KRAS靶点中。
对于目前众多KRAS靶点竞争者而言,谁能成为吉非替尼,谁就有希望在这一靶点抢占先机。大量的现实世界数据足以给后续耐药性提供数据支撑,这可以帮助先人一步的获得次世代产品的*优势。
聚焦KRAS靶点,它是NSCLC中仅次于EGFR靶点的重要赛道,如果后续各路玩家可以投入充足的研发资金,那么这个赛道是有可能成为第二个EGFR的。而*个赢家则有望复制阿斯利康在EGFR赛道的成功。
此外,KRAS靶点还在胰腺癌、肠胃癌等其他癌种有应用空间,或将进一步放大这一靶点的潜在价值。





